
Teori Tentang Atom
Atom merupakan satuan terkecil dalam materi baik berupa benda cair, padat, dan gas. Atom yang ada menjadi bahan dasar pembentukan materi-materi yang ada sampai kepada bentuk yang dapat dirasakan oleh manusia. Seperti air, meja, handphone serta benda yang berbentuk gas seperti angin.
Kata atom berasal dari bahasa Yunani yaitu "atomos" yang berarti "tidak dapat dibagi". Konsep dasar atom pertama kali dikemukakan oleh Democritus (orang Yunani) pada awal abad ke-4 Sebelum Masehi. Menurut Democritus, atom berbentuk padat, tidak memiliki struktur internal, serta ada ruang kosong antar atom untuk memberikan ruang untuk pergerakannya (seperti pergerakan dalam air dan udara, atau fleksibilitas benda padat). Selain itu, atom dibedakan ke dalam bentuk, massa dan ukurannya. Berdasarkan model atom yang telah dibuat oleh Democritus mampu menjelaskan bahwa semua benda terdiri dari bagian yang lebih kecil disebut atom. Namun model Democritus ini kurang memiliki bukti eksperimental hingga mulai tahun 1800an muncul teori-teori baru berdasarkan hasil eksperimen.
Dalam pembagiannya striktur atom terdiri atas 3 inti materi yang memiliki fungsi dan tungasnya tersendiri. Yaitu proton, elektron, dan neutron. Proton dan Neutron berada dalam inti atom. Sedangkan, elektron berputar mengelilingi inti atom berupa proton dan neutron.
Perlu diketahui bahwasanya Proton merupakan struktur atom yang bermuatan positif (+). Neutron merupakan struktur atum yang bermuatan netral. Dan elektron merupakan struktur aton yang bermuatan negatif (-). Sehingga, dalam struktur atom yang berada dalam sistem periodik unsur yang kita ketahui dipengaruhi oleh daya tarik menarik antara elektron dan proton dalam inti atom.
A. Teori Atom Dalton
Menjelang akhir abad ke-18, dua kaidah tentang reaksi kimia muncul tanpa mengacu pada gagasan teori atom. Pertama adalah hukum kekekalan massa, yang dirumuskan oleh Antoine Lavoisier pada tahun 1789, yang menyatakan bahwa total massa dalam reaksi kimia adalah tetap (yaitu, reaktan memiliki massa yang sama dengan produk). Kaidah kedua adalah hukum perbandingan tetap. Kaidah ini pertama kali dibuktikan oleh kimiawan Prancis Joseph Louis Proust pada tahun 1799. Hukum ini menyatakan bahwa jika suatu senyawa dipecah menjadi unsur-unsur penyusunnya, maka massa konstituen akan selalu memiliki perbandingan yang sama, terlepas dari kuantitas atau sumber substansi aslinya.
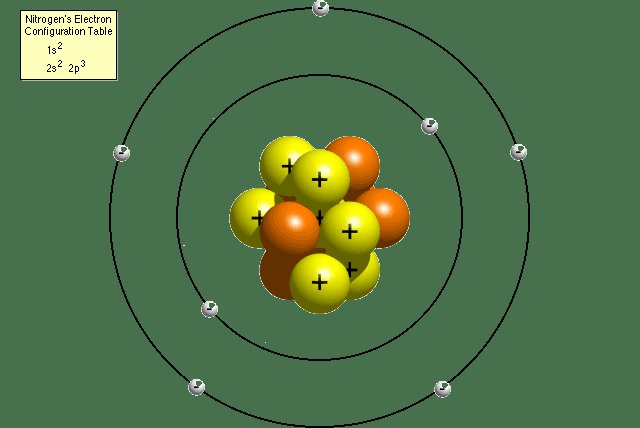
Teori atom Dalton adalah teori mengenai atom yang dikemukakan oleh ilmuwan berkebangsaan Inggris, John Dalton. Pada tahun 1808. Teori atom Dalton adalah teori paling tua mengenai penjelasan tentang atom. Dalton menjelaskan bahwa atom merupakan suatu zat yang tidak bisa dibagi – bagi lagi.
Toeri atom dalton merupakan teori atom pertama yang dikemukakan oleh John Dalton (1808), seorang fisikawan asal Inggris. Dalam mengemukakan teorinya terkait struktur atom yang berdasarkan penelitian yang dikemukakannya dalam A New System of Chemical Philosiphy. Dimana jogn Dalton menjelaskan bahwasanya atom merupakan suatu zat yang tidak dapat dibagi lagi dan merupakan struktur terkecil dari suatu materi.
Berdasarkan dari hasil penelitian yang dilakukannya John Dalton Mengemukakan Penelitiannya terkait struktur atom sebagai berikut :
- Materi terdiri atas atom yang tidak dapat dibagi lagi.
- Semua atom dari unsur kimia tertentu memiliki massa dan sifat yang sama.
- Unsur kimia yang berbeda akan memiliki jenis atom yang berbeda.
- Selama reaksi kimia, atom- atom hanya dapat bergabung dan dipecah menjadi atom- atom yang terpisah, tetapi atom tidak dapat dihancurkan dan tidak dapat diubah selama reaksi kimia tersebut.
- Suatu senyawa terbentuk dari unsur- unsurnya melalui penggabungan atom tidak sejenis dengan perbandingan yang sederhana.
Dari hasil penelitian yang dikemukakan oleh John Dalton, Dalton menggambarkan bahwasanya atom merupakan suatu bulatan materi terkecil yang tidak dapat dibagi lagi. Bentuk atom yang digambarkan berdasarkan teori atom Dalton ini berbentuk bola kecil yang menjadi inti atom. Kemudian, setiap atom yang bergabung akan membentuk senyawa dan menjadi materi.
Berdasarkan hasil penelitiannya dan perkembangan masa. Teori yang dikemukakan oleh John dalton memiliki kekurangan dari teori atom yang lainnya. Dengan berbagai kelemahan sebagai berikut :
- Dalton menerangkan bahwa atom tidak bisa dibagi lagi. Namun, setelah perkembangan ilmu pengetahuan dan ilmu teknologi. Diketahui bahwasanya dalam inti atom yang dijelaskan oleh Daltom masih dapat terbagi lagi yang terbentuk dari partikel dasar yang lebih kecil daripada atom, yaitu elektron, proton, dan neutron.
- Dalton menyatakan bahwa atom tidak bisa diciptakan ataupun dimusnahkan. Namun, ketika atom di uji coba dengan rekasi nuklir akan menghasilkan satu atom menjadi suatu unsur atom yang lain.
- Pendapat Dalton terkait bahwasanya setiap atom memiliki kesamaan dalam massa, ukuran dan bentuk. Namun, setelah adanya teori terkait Isotop, Isobar, dan Isoton. Dimana, setiap struktur atom mempunyai kesamaan dalam satu sisi namun, berbeda dalam sisi lainnya.
- Pernyataan Dalton terkait perbandingan suatu senyawa mempunyai bilangan bulat dan sederhana. Tetapi, seiring perkembangan dari diketahui bahwa terdapat perbandingan bilangan yang tidak bilat seperti senyawa C18H35O2Na.
Walau masih memiliki kelemahan dari berbagai sisi. John Dalton menjadi pelopor pertama dalam ilmuan yang menjelaskan terkait struktur atom dam model atom. Yang dengan dasar inilah para ilmuan lain mulai meneliti dan memulai percobaan dan penelitian terkait struktur atom dan model atom.
B. Teori Atom Thomson
.J. Thomson pada awal 1900an, mengemukakan teori baru tentang atom. Menurutnya di dalam atom terdapat partikel elektron dan proton. Berdasarkan hasil eksperimennya, proton memiliki massa yang jauh lebih besar dibandingkan elektron, sehingga model atom Thomson menggambarkan atom sebagai proton tunggal yang besar.
Dengan menggunakan hasil penelitian dan penemuan tabung katode oleh William Crookers. Kemudian J.J Thomson pun mulai meneliti terkait sinar katode yang mampu menggerakan baling-baling dalam percobaan tabung katode. Dari hasil percobaan tabung katode tersebut dapat dipastikan bahwa sinar katode merupkan salah satu perikel penyusun dalam atom yang bermuatan negatif.
Di dalam proton terdapat elektron elektron yang menetralkan adanya muatan positif dari proton. Menurut Thomson, atom terdiri dari suatu bulatan bermuatan positif dengan rapat muatan yang merata. Di dalam muatan positif ini tersebar elektron dengan muatan negatif yang besarnya sama dengan muatan positif. Secara garis besar teori atom thomson adalah “Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron.”
Secara sederhana model atom thomson dapat analogikan sebagai jambu biji yang telah dikelupas kulitnya. Biji jambu yang tersebar merata dimodelkan sebagai elektron dan bulatan daging jambu yang pejal dimodelkan sebagai proton.
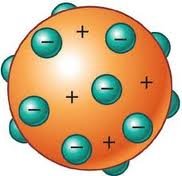
Berdasarkan hasil penelitian oleh Thomson. Model atom thomson digambarkan sebagai roti kismis atau bola pejal layaknya bola billiar. Dimana, inti bola yang berwarna kuning sebagai muatan positif dan bola kecil berwarna hijau sebagai muatan negatif yang menyebar merata di sekitar muatan positif.
Walaupun J.J Thomson mampu menemukan muatan negatif atau elektron yang tersebar disekitar struktur atom. Serta mematahkan bahwa atom masih dapat dipecah menjadi bagian terkecil dengan ditemukannya elektron. Tetapi, J.J Thomson tidak dapat menjelaskan persebaran muatan positif dan negatif yang berada di inti atom
C. Teori Atom Rutherford
Memasuki tahun 1903 seorang peneliti dengan percobaan yang dilakukannya menyatakan bahwa teori atom yang dipaparkan oleh J.J Thomson belum tepat.
Mendengar hal tersebut mendorong Ernest Rutherford (1911) untuk melakukan percobaan untuk mencari struktur atom yang benar. Dengan bantuan dari kedua muridnya Hans Geiger dan Ernest Marsden. Rutherford melakukan eksperimen dengan menembakkan sinar alfa ke sebuah lepengan emas dengan partikel alfa yang percobaan ini dikenal dengan percobaan Geiger-Marsden.
Saat melakukan tembakan sinar ke lempengan tersebut. Rutherford menemukan bahwa sinar alfa yang ditembakkan menghasilkan sinar yang dibelokkan, dipantulkan, dan diteruskan. Rutherford menjelaskan dari hasil percobaan yang dilakukan bahwasanya.
- Didalam struktur atom terdapat ruang hampa yang menghasilkan partikel α akan diteruskan.
- Terdapat suatu muatan dalam inti atom dan memiliki massa atau muatan yang sejenis denganpartikel α sejenis yaitu muatan positif; sehingga, sebagian kecil partikel α yang ditembakkan.
- Pada struktur atom terdapat bagian yang kecil dan padat yang rutherfor menyebutnya sebagai inti atom (Nukleus). Sehingga, partikel α yang tiembbakan dan mengenai inti atom akan dipantulkan oleh inti atom tersebut.
Berdasarkan hasil percobaan yang didapatkan oleh Rutherford dan beserta kedua muridnya. Rutherford pun menyatakan bahwa : struktur atom tersusun dari inti atom yang bermuatan positif sebagai pusat massa dan dikelilingi elektron-elektron yang bermuatan negatif yang mengitari inti atom.
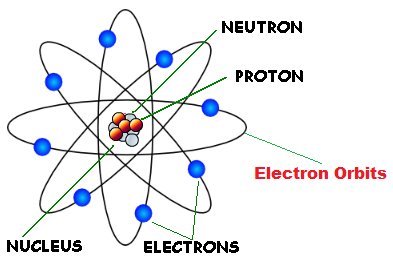
Dengan demikian, Rutherford menggambarkan seperti bola yang sebahagian besarnya merupakan ruang hampa. Dimana, pada tengah atom merupakan inti atom terdiri dari atom positif. Kemudian, muatan atom yang berada ditengah atom memiliki volume yang sangat kecil yang sebanding dengan muatan atom tersebut.
Dikarenakan keberhasilannya menjelaskan perkembangan dari teori atom Dalton dan Thomson. Nama Ernest Rutherford pun diabadikan sebagai salah satu teori dalam perkembangan ilmu fisika dan kimia dengan teori atom Rutherford dalam menjelaskan adanya elektron – elektron negatif.
Namun, Teori atom Rutherford ini hanya mampu menjelaskan terkait adanya elektron negatif yang beredar mengelilingi inti atom yang terletak diruang hampa. Tetapi, Rutherford bemum dapat memberi penjelasan terkait distribusi setia atom elektron dengan jelas. Secara otomatis Teori yang dipaparkan oleh rutherofd pun memiliki kelemahan.
Teori atom Rutherford memiliki pertentang dengan Hukum Maxwell seorang ahli fisika. Dimana Maxwell menyatakan bahwa jika muatan elektron (negatif) bergerak dan mengelilingi suatu partikel yang berlawanan (bermuatan positif). Maka, pertikel yang ada akan mengalami percepatan kemudian akan menghasilkan gelombang elektromagnetik.
Akibatnya energi elektron semakin berkurang. Jika demikian halnya maka lintasan elektron akan berupa spiral. Pada suatu saat elektron tidak mampu mengimbangi gaya tarik inti dan akhirnya elektron jatuh ke inti. Sehingga atom tidak stabil padahal kenyataannya atom stabil.
Sehingga, akan menyebabkan elektron akan berkurang sedikit demi sedikit. Maka, hal yang selanjutnya yang terjadi adalah lintasan elektron menjadi spiral dikarenakan tidak mampu mengimbangi gaya tarik dari intri atom dan akhirnya elektron jatuh ke inti atom. Dan akan menghasilkan atom yang tidak stabil tetapi, pada kenyataannya atom stabil.
D. Teori Atom Niels Bohr
Pada tahun 1913, Neils Bohr memperbaiki kegagalan atom Rutherford melalui percobaannya tentang spektrum atom hidrogen. Berdasarkan hasil percobaannya Bohr memberikan gambaran keadaan/kedudukan orbit elektron dalam menempati daerah di sekitar inti atom. Menurut Bohr elektron mengelilingi inti atom pada orbit tertentu, hanya terdapat orbit dalam jumlah tertentu dan perbedaan antar orbit satu dengan yang lain adalah jarak orbit dari inti atom.
Keberadaan elektron baik di orbit yang rendah maupun yang tinggi sepenuhnya tergantung oleh tingkatan energi elektron. Sehingga elektron di orbit yang rendah akan memiliki energi yang lebih kecil daripada elektron di orbit yang lebih tinggi.
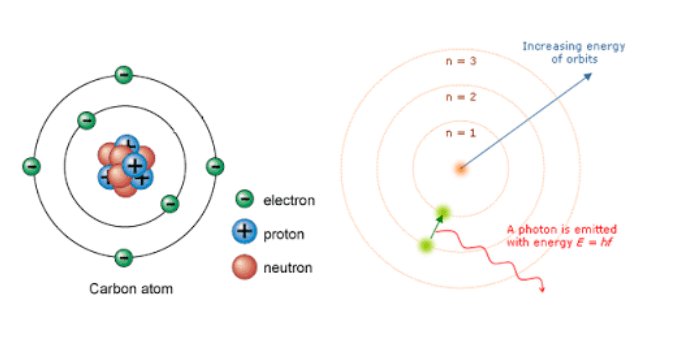
Dari penjelasan teori atom Bohr. Niels Bohr pun menggambarkan model atom Bohr dengan bentuk seperti tata surya yang terkadang diistilahkan sebagai model atom tata surya. Dimana, Bohr menjelaskan bahwa model atom Bohr sebagai berikut :
- Elektron yang berada di lintasannya tersendiri mengelilingi inti atom dengan setiap elektron berada pada lintasanya tersendiri. Dalam hal ini Niels Bohr memisalkan dengan istilah lintasan K, L, M, … dan lintasan seterusnya.
- Setiap elektron yang berotasi pada lintasanya dan bersifat stasioner. Maka, energi elektron terhadapt inti atom dalam struktur atom akan bersifat tetap. Artinya, tidak akan ada energi yang diserap ataupun diemisikan satu sama lain.
- Setiap muatan elektron dalam setiap lintasan dapat berpindah dari satu lintasan ke lintasan lain dengan setiap lintasan akan membutuhkan energi yang berbeda. Dari energi yang dibutuhkan oleh setiap elektron disetiap lintasan kulit tersebut akan membuat elektron mampu berpindah dari satu orbit ke orbit lainnya. Dimana, besarnya energi yang diperlukan untuk berpindah dapat dihitung dengan persamaan Planck.
- Setiap Orbit stasioner muatan elektron yang mengelilingi inti atom momentum sudut. Dimana, besarnya jumlah sudut merupakan kelipatan dari nh/2π. Dimana, setiap n merupakan bilangan kulangan kuantum dan h merupakan tetapan Planck. Setiap kulit atom yang dilambangkan dengan n = 1, n = 2, n = 3. dan seterusnya.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.












Belum Ada Komentar